 DOC
DOC
【文档说明】20.docx,共(4)页,390.062 KB,由小赞的店铺上传
转载请保留链接:https://www.doc5u.com/view-c06a4114a4df4a90ada73819d2ca8dc0.html
以下为本文档部分文字说明:
课时作业20硫酸含硫物质的转化1.下列叙述或操作正确的是()A.浓硫酸具有强氧化性,稀硫酸无氧化性B.浓硫酸不慎沾到皮肤上,立即用NaOH溶液冲洗C.稀释浓硫酸时应将水沿着烧杯壁慢慢地注入盛有浓硫酸的烧杯中,并
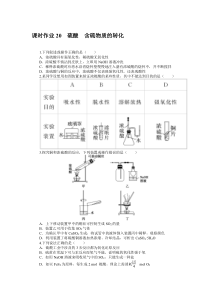
不断搅拌D.浓硫酸与铜的反应中,浓硫酸不仅表现强氧化性,还表现酸性2.某同学设想用如图装置来验证浓硫酸的某些性质,其中不能达到目的的是()3.探究铜和浓硫酸的反应,下列装置或操作错误的是()A.上下移动装置甲中的铜丝可控制生成SO2的量B.装置乙可用于收集SO2气体C.为确认甲中有CuSO4
生成,将试管中的液体倒入装置丙中稀释,观察颜色D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5H2O4.下列说法正确的是()A.硫酸工业中涉及的3步反应都为氧化还原反应B.硫黄在常温下可与汞反应而氧气不能,说明硫的氧化性强于氧
C.如用NaOH溶液来吸收尾气中的SO2,只能生成一种盐D.如以FeS2为原料,每生成2mol硫酸,理论上需消耗154molO25.“蓝天保卫战”需要持续进行大气治理,有效处理SO2、NO2等大气污染物。化学研究为生产、生活处
理废气,防止大气污染做出重要贡献。将SO2转化为K2SO4的工艺流程如图,下列说法正确的是()A.通入空气的目的是将CO2完全吹出B.反应时应将CaCO3粉碎C.固体产物A是CaSO3D.“高温”时只发生CaCO3的分解反应6.某实验小组同学探究不同金属和浓硫酸的反应,向三等
份浓硫酸中分别加入大小相同的不同金属片,加热,用生成的气体进行下表实验操作并记录实验现象。已知:H2S+CuSO4===CuS↓+H2SO4(CuS为黑色固体);H2S可燃。下列说法不正确的是()A.加入铜片的实验中,使酸性KMnO4溶液褪色的气体是SO2B.加入铝片的实验中,燃烧现象能证
明生成气体中一定含H2SC.加入锌片的实验中,生成的气体一定是混合气体D.金属与浓硫酸反应的还原产物与金属活动性强弱有关7.在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶液所含离子的推断中正确的
是()A.一定会有SO2-4B.含有SO2-4和Ag+C.可能含有SO2-4、Ag+、SO2-3中的一种或同时含有SO2-4、SO2-3D.可能含有SO2-3或CO2-38.下列四支试管中分别盛有固体NaBr、NaCl、Na2SO3、Cu
,分别向这四支试管中加入适量浓硫酸,部分现象如图所示:下列判断正确的是()A.反应①和②的现象说明还原性:Br->Cl-B.浓硫酸与NaCl不反应,白雾是浓硫酸吸水所致C.反应③的现象说明氧化性:浓硫酸>Na2S
O3D.反应④的现象除产生刺激性气味的气体外,溶液中还析出蓝色晶体9.实验小组制备焦亚硫酸钠(Na2S2O5)并探究其性质。资料:焦亚硫酸钠为白色晶体,可溶于水。(1)制备Na2S2O5(夹持装置略)将尾气处理装置C补充完整并标明所用试剂。(2)探究Na2S2O5的性
质实验编号实验操作及现象实验Ⅰ取B中少量白色晶体于试管中,加入适量蒸馏水,得溶液a,测得溶液呈酸性实验Ⅱ取少量溶液a于试管中,滴加足量氢氧化钡溶液,有白色沉淀生成,过滤后,将沉淀放入试管中,滴加过量盐酸,充分振荡,产生气泡,白色沉淀溶解实验Ⅲ
取B中少量白色晶体于试管中,滴加1mL2mol·L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去实验Ⅳ取B中少量白色晶体于大试管中加热,将产生的气体通入品红溶液中,红色褪去;将褪色后的溶液加热,红色恢复①由实验Ⅰ可知,Na2S2O5溶于水,溶液呈酸性的原因是(用化学方程式表示)。②实
验Ⅱ中向白色沉淀中滴加过量盐酸,沉淀溶解,用平衡原理解释原因:______________________________________________________________________________________________
____________________________________________________________________________________________________
______________________。③实验Ⅲ中经测定溶液中产生Mn2+,该反应的离子方程式是。④从上述实验探究中,体现出Na2S2O5具有性质(至少说出两点)。