 DOC
DOC
【文档说明】云南省弥勒一中2020-2021学年高二上学期第10周周测化学试题含答案.docx,共(9)页,91.869 KB,由管理员店铺上传
转载请保留链接:https://www.doc5u.com/view-c3cd8b92b7d5278c9005494497c0a812.html
以下为本文档部分文字说明:
弥勒一中高二上学期第10周周测姓名:___________班级:_____________一、单选题1.已知:Fe2O3(s)+32C(s)=32CO2(g)+2Fe(s)ΔH=+234.14kJ/mol,C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mo
l,则2Fe(s)+32O2(g)=Fe2O3(s)的ΔH是()A.-824.4kJ/molB.-627.6kJ/molC.-744.7kJ/molD.-169.4kJ/mol2.Fenton法常用于处理含难降解有机物的工业废水,往调节
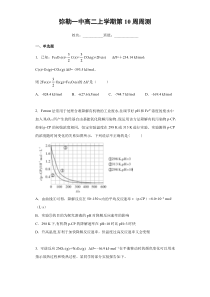
好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,控制p-CP的初始浓度相同,恒定实验温度在298K或313K进行实验。实验测得p-CP的浓度随时间变化的关系如图所示,下列说法不正确的是()A.由曲线①可得,降解反应在5
0~150s内的平均反应速率v(p-CP)=8.0×10-6mol/(L·s)B.实验③的目的为探究溶液的pH对降解反应速率的影响C.298K下,有机物p-CP的降解速率在pH=10时比pH=3时快D.升高温度,有利于加快降解反应速率,但温度过高反应速率又会变慢3.可逆反应2NO2
(g)⇌N2O4(g)ΔH=−56.9kJ·mol−1在平衡移动时的颜色变化可以用来指示放热过程和吸热过程。某同学的部分实验报告如下。1.向左侧烧杯中加入NH4NO3晶体,甲瓶的红棕色变浅。2.向右侧烧杯中加入CaO固体,乙瓶的红棕色变深。下
列说法不正确的是()A.甲瓶的红棕色变浅,说明平衡2NO2(g)⇌N2O4(g)向正反应方向移动B.可根据现象判断NH4NO3晶体溶于水吸热,CaO固体溶于水放热C.甲瓶中反应的化学平衡常数(K)增大D.乙瓶中由于反应的化学平衡常数(K)改变,使Qc<K,平衡发生移动4.下列有关
化学反应方向及其判据的说法中错误的是()A.1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)]B.自发反应的熵一定增大,非自发反应的熵一定减小C.反应:CaCO3(s)=CaO(s)+CO2(g)能否自发
进行,主要由ΔS>0决定D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)ΔH=+185.57kJ·mol-1能自发进行是因为体系有自发地向混乱度增大的方向转变的倾向5.已知醋酸溶液中存在平衡CH3COOHCH3COO-+H+,为使溶液中-33c(CHCOO)c(CHCO
OH)的值增大,可以采取的措施是:①加Zn粉;②加少量同浓度的醋酸溶液;③加少量CH3COONa;④加少量浓盐酸;⑤加水。()A.①②③B.①③⑤C.②③⑤D.①②④6.常温下,有下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的
NaOH溶液。下列有关说法正确的是()A.四种溶液的Kw相同,由水电离的c(H+):①=③>②=④B.向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>②>①C.①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大D.将②、③两种溶液混合后,若pH=7,消耗溶液的体积为③>
②二、计算题7.某温度下,在2L密闭容器中充入4molA气体和3molB气体,发生下列反应:2A(g)+B(g)C(g)+xD(g),5s达到平衡。达到平衡时,生成了1molC,测定D的浓度为1mol/L。(1)求x=____。(2)求这段时间A的平均反应速率为__
___。(3)求该温度下反应平衡常数为__________8.室温下,pH=2的某酸HnA(An-为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为8。(1)写出生成的正盐的分子式:__________。(2)已知室温时,0
.1mol/L的某一元酸HA在水中有0.1%发生电离,回答下列各问题:①该溶液的pH=________。②HA的电离平衡常数K=______________③升高温度时,K将_________(填“增大”,“减小”或“不变”),pH将_
________(填“增大”,“减小”或“不变”),④由HA电离出的c(H+)约为水电离出的c(H+)的___________倍。9.按要求计算下列溶液的pH(常温下,忽略溶液混合时体积的变化):(1)0.1mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×
10-5)________;(2)0.1mol·L-1的NH3·H2O(NH3·H2O的电离度α=1%,电离度=已电离的弱电解质浓度弱电解质的初始浓度×100%)________;(3)pH=2的盐酸与等体积的水混合________;(4)
常温下,将0.1mol·L-1氢氧化钠溶液与0.06mol·L-1硫酸溶液等体积混合________;(5)25℃时,pH=3的硝酸和pH=12的氢氧化钡溶液按照体积比为9∶1混合________。参考答案1.A【详解】已知①Fe2O3(s)+32C(s)=3
2CO2(g)+2Fe(s)ΔH=+234.14kJ/mol,②C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol,根据盖斯定律,将②×32-①,整理可得2Fe(s)+32O2(g)=Fe2O3(s)的ΔH=-824.4kJ/mol,故答案为A。2.C
【详解】A.由曲线①可得,降解反应在50~150s内的平均反应速率v(p-CP)=1.2-0.4mol/L(15050)s=−()8.0×10-6mol/(L·s),故A正确;B.实验③与实验①②的pH不同,实验③的目的为探究溶液的pH
对降解反应速率的影响,故B正确;C.根据图示,298K下,有机物p-CP的降解速率在pH=3时比pH=10时快,故C错误;D.升高温度,有利于加快降解反应速率,但温度过高,过氧化氢分解,所以反应速率又会变慢,故D正确;选C。3.D【
详解】A.甲瓶的红棕色变浅,说明NO2浓度减小,平衡2NO2(g)⇌N2O4(g)向正反应方向移动,故A正确;B.左侧烧杯中加入NH4NO3晶体,甲瓶的红棕色变浅,说明左侧平衡正向移动,向右侧烧杯中加入CaO固体,乙瓶的红棕色变深,说明右侧平衡逆向移动,2NO2(g)⇌N
2O4(g)正反应放热,根据现象可判断NH4NO3晶体溶于水吸热,CaO固体溶于水放热,故B正确;C.甲瓶的红棕色变浅,说明NO2浓度减小,平衡2NO2(g)⇌N2O4(g)向正反应方向移动,甲瓶中反应的化学平衡常数(K)增大,故C正确;D.乙
瓶的红棕色变深,说明右侧平衡逆向移动,反应的化学平衡常数(K)减小,Qc>K,故D错误;选D。4.B【详解】A.物质聚集状态不同熵值不同,气体S>液体S>固体S,1molH2O在不同状态时的熵值:S[H2O(s)]<S[H2O(g)],故A正确;B.若△H<0,△S>0,则一定自发,若△H>
0,△S<0,则一定不能自发,若△H<0,△S<0或△H>0,△S>0,反应能否自发,和温度有关,则说明自发反应的熵不一定增大,非自发反应的熵也不一定减小,故B错误;C.CaCO3(s)=CaO(s)+CO2(g)是△H>0、△
S>0的反应,由△G=△H-T△S<0可自发进行可知,主要由ΔS>0决定,需要在高温下才能自发进行,故C正确;D.由反应可知,△H>0、△S>0,能自发进行,则△H-T△S<0,则能自发进行,是因为体系有自发地向混乱度增大的方向
转变的倾向,故D正确;故答案为B。5.B【详解】①加Zn粉,Zn和H+反应,使电离平衡正向移动,促进醋酸电离,导致该比值增大,①正确;②加少量同浓度的醋酸溶液,醋酸电离程度不变,则溶液中该比值不变,②错误;③加少量C
H3COONa,c(CH3COO-)增大而导致电离平衡逆向移动,但是平衡移动的趋势是微弱,最终达到平衡时该比值增大,③正确;④加少量浓盐酸,溶液中c(H+)增大而使电离平衡逆向移动,最终使该比值减小,④错误;⑤加水稀释
促进醋酸电离,导致n(CH3COOH)减小、n(CH3COO-)增大,对于同一溶液来说,溶液的体积相同,故该溶液中-33c(CHCOO)c(CHCOOH)增大,⑤正确;综上所述可知:说法正确的是①③⑤,故合理选项是B。6.B【详解】A.酸或碱都抑制水电离,酸中氢离子或碱中
氢氧根离子浓度越大,其抑制水电离程度越大,①②中氢离子浓度相等、③④中氢氧根离子浓度相等,则抑制水电离程度相等,则由水电离的c(H+):①=③=②=④,故A错误;B.加水稀释促进弱电解质电离,强酸强碱溶液的pH变化幅度较大,则向等体积的四种溶液中分别加入100mL水后,溶液的
pH:③>④>②>①,故B正确;C.溶液的体积未知,无法计算生成氢气的量,故C错误;D.pH=2的HCl溶液和pH=12的氨水等体积混合后溶液显碱性,现混合后溶液呈中性,可知消耗溶液的体积②>③,故D错误;故答案为B。
7.20.2mol/(L•s)0.5【详解】(1)5s达到平衡,测定D的浓度为1mol/L,则D的物质的量是1mol/L×2L=2mol,达到平衡时,生成了1molC,C、D的物质的量比等于系数比,则x=2;(2)5s达到平衡,达到平衡时,生成了1molC,则消耗2molA,A的平均反
应速率=Δ2mol=Δt2L5snV=0.2mol/(L•s);(3)()()()2A(g)B(g)C(g)2D(g)mol/L21.500mol/L10.50.51mol/L110.51++初始转化平衡该温
度下反应平衡常数K=2210.50.511=。8.BnAm41.0×10-7增大减小106(1)常温下pH=2的某酸HnA(An-为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为8,说明B(OH)m为弱碱,且碱过量,根据化合物中化合价的代数和为0确定其
化学式;(2)①根据酸的浓度和电离度计算溶液中c(H+),利用pH=-lgc(H+)计算溶液的pH大小;②根据电离平衡常数的含义计算K值;③弱酸电离过程吸收热量,根据平衡移动原理分析温度对电离平衡常数及溶液中c(H+
)的影响;④HA电离产生c(H+)=c(HA)×电离度,溶液中水电离产生的c(H+)水=c(OH-),根据水的离子积常数计算,然后进行比较。【详解】(1)HnA中A的化合价是-n价,B(OH)m中B的化合价
是+m价,根据化合物中化合价的代数和为0知,二者的离子个数之比为n:m,则其化学式为:BnAm;(2)①0.1mol/L的某一元酸HA在水中有0.1%发生电离,则c(H+)=0.1mol/L×0.1%
=1.0×10-4mol/L,所以溶液的pH=-lgc(H+)=4;②弱酸溶液中存在电离HAH++A-,由于酸电离程度很小,所以平衡时c(H+)≈c(A-)=0.1mol/L×0.1%=1.0×10-4mol/L,c(HA)=0
.1mol/L-10-4mol/L≈0.1mol/L,所以电离平衡常数K=4410100.1−−=1.0×10-7;③电离过程吸收热量,根据平衡移动原理:升高温度,电离平衡正向移动,溶液中离子浓度增大,电解质分子浓度减小
,所以电离平衡常数增大;电离平衡正向移动,使溶液中c(H+)增大,c(H+)增大,则溶液的pH减小;④HA电离产生的c(H+)=0.1mol/L×0.1%=1.0×10-4mol/L,室温下水的离子积常数Kw=1.0×10-14,则水电离产生的c(H+)水=c(
OH-)=1441.0101.010−−mol/L=1.0×10-10mol/L,因此()()()()cHcH++酸水=4101.010mol/L1.010mol/L−−=106。9.2.9112.3210(1)根据电离平衡常数的含义,首先计算出溶液的c(H+),然后根据pH=-lgc(
H+)计算;(2)根据电离度概念计算出溶液中c(OH-)在结合常温下水的离子积常数Kw=10-14计算出溶液中c(H+),最后根据pH=-lgc(H+)计算溶液的pH值;(3)先计算出酸稀释后溶液中c(H+),最后根据pH=-lgc(H+)计算溶液的pH值;(4)首先根据H++OH-=H
2O判断混合溶液中过量的离子的物质的量浓度,然后根据pH=-lgc(H+)计算溶液的pH值;(5)首先根据H++OH-=H2O,结合两种溶液的pH和混合溶液的体积关系判断混合溶液中过量的离子的物质的量浓度,然后根据pH=-lgc(
H+)计算溶液的pH值。【详解】(1)CH3COOHCH3COO-+H+,假设达到电离平衡时c(H+)=x,则c(CH3COO-)=x,c(CH3COOH)=0.1-x,所以K=2x0.1x−=1.8×10-5,解得c(H+)≈1.3×10-3
mol/L,所以pH=-lgc(H+)=-lg(1.3×10-3)≈2.9。(2)一水合氨在溶液中存在电离平衡NH3·H2ONH4++OH-,由于其电离度为1%,所以达到电离平衡时溶液中c(OH-)=0.1mol/L×1%=10-3mol/L,c(H
+)=1431010−−mol/L=10-11mol/L,所以pH=-lgc(H+)=11;(3)pH=2的盐酸与水等体积混合后,酸溶液中H+的浓度酸c(H+)=2102−mol/L,pH=-lg2102−=2+lg2≈2.3;(4)0.1mol/LNaOH溶液中
c(OH-)=0.1mol/L,0.06mol/L的硫酸溶液中c(H+)=0.06mol/L×2=0.12mol/L,所以二者等体积混合后溶液呈酸性,混合溶液中c(H+)=(0.12-0.1)÷2=0.01mol/L,
则pH=-lg0.01=2;(5)pH=3的硝酸溶液中c(H+)=10-3mol/L,pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,二者以体积比9∶1混合,Ba(OH)2过量,溶液呈碱性,混合溶液中c(OH-)=231
0110991−−−+=1×10-4mol/L,则混合后c(H+)=-Kwc(OH)=1441010−−mol·L-1=1×10-10mol/L,则pH=-lg10-10=10。