 PDF
PDF
【文档说明】第01章 物质及其变化-2019-2020学年九年级科学章节知识框架思维导图(浙教版)素材.pdf,共(8)页,1.857 MB,由管理员店铺上传
转载请保留链接:https://www.doc5u.com/view-55c3c9e774586602e02f164830b130f5.html
以下为本文档部分文字说明:
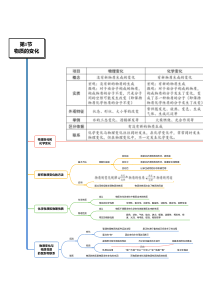
第1节物质的变化物理变化和化学变化探究物质变化的方法基本方法观察和实验变化前观察并记录物质的形态、颜色等变化中观察并记录物质的形态、能量变化等现象变化后记录生成物的形态和颜色等应用通过寻找规律发现物质的性质物质的性质决定了物质的用途化学性质和物理性质化学性质定义物质在化学变化中表现出来的性质常见的
化学性质可燃性、氧化性、还原性、酸碱性、活泼性、稳定性、助燃性等物理性质定义物质不需要发生化学变化就能表现出来的性质常见的物理性质颜色、状态、气味、熔点、沸点、硬度、溶解性、挥发性、密度、光泽、导电性、磁性、吸附性等物质变化与物质性质的区别
和联系区别变化强调的是物质的某种运动过程是正在进行着的或已经发生了的过程重点在“变”因此变化往往用动词表示性质是物质本身所具有的特征不论变化是否正在进行都是客观存在的事实性质往往用“能”“不能”“可以
”“不可以”“会”“容易”“难”等文字描述联系物质的性质是物质发生变化的内因而物质的变化则是物质性质的具体体现因此第2节物质的酸碱性根据物质的酸碱性分类电离物质溶解于水或受热熔化而形成的自由移动离子的过程酸性物质酸
的定义在水中电离时生成的阳离子都是氢离子的化合物常见的酸性物质食醋、盐酸、硫酸、硝酸、碳酸等酸的电离酸根离子某种酸电离产生的阴离子碱性物质碱的定义在水中电离时生成的阴离子都是氢氧根离子的化合物常见的碱性物质石
灰水、氨水、烧碱、熟石灰、氢氧化钾、氢氧化钡等碱的电离酸碱指示剂在酸性或碱性溶液里能显示出不同颜色的物质简称指示剂只能测量溶液的酸碱性(只能定性)不能衡量酸碱性的强弱(不能定量)常用酸碱指示剂在溶液中的变色情况注意某溶液滴入无
色酚酞试液不变色该溶液不一定是酸性溶液也可能是中性溶液指示剂遇酸性或碱性溶液变色的过程是化学变化不溶于水的酸或碱不能使指示剂变色酸碱指示剂适用的对象是溶液不溶于水不能形成溶液溶液酸碱性的强弱程度溶液的酸碱度常用pH表示pH溶液酸碱性强弱的程度
取值范围通常为0~14pH越低酸性越强pH越高碱性越强pH等于7的物质呈中性用pH试纸测定物质的酸碱性强弱用洁净的玻璃棒礁取被测试的溶液滴在pH试纸上将试纸显示的颜色与标准比色卡对照看与哪种颜色最接近从而确定被测溶液的pH用pH试纸测试的方法比较粗糙精确的测试可使用一种称为酸度计的仪
器溶液的酸碱性与生命活动的关系人体健康人体胃液的正常pH为0.8~1.5如果胃酸分泌过多使胃液pH下降容易出现胃痛等症状人体血液的pH为7.39~7.45血液的ph下降到7.0以下或7.8以上人就会有生命危险生活人的汗液的pH为5.5~5.6洗衣皂、香皂、药皂的pH不同洗衣皂
的pH高碱性强适合洗衣物香皂、药皂pH低适用于洗脸、洗澡牛奶的pH通常小于7酱油的pH为4.8左右番茄的pH≤4.5食醋里含有醋酸,pH为3左右生鲜肉的pH为7.0~7.4生肉放久后由于肉中蛋白质凝固失去一些水分pH变为5.4~5.5农业
生产中性土壤最适宜微生物的生长繁殖有利于土壤中有机质向有效养分转化促进农作物生长pH为4~6的土壤会使农作物根系发黑pH为8以上的土壤会腐蚀农作物并板结成块盐碱地的pH多在9以上草木难生环境雨水因溶液有空气中的二氧化碳而略显酸性正常雨水的pH≈5.6通常把pH<5.6的降水称为酸雨第3节
常见的酸盐酸物理性质无色有刺激性易挥发所以要密封保存用途盐酸是重要的化工原料用于除锈、制药人需要用盐酸帮助消化稀盐酸的化学性质与硝酸银的反应化学反应方程式现象产生白色沉淀滴加稀硝酸不溶解应用用于检验盐酸和氯离子的存在与鸡蛋壳的反应化学反应方程式现象
产生大量的气泡生成的气体能使燃着的火柴熄灭与铁锈的反应化学反应方程式现象红褐色的铁锈逐渐溶解溶液由无色变为黄色与铁的反应化学反应方程式现象有气泡产生溶液由无色变为浅绿色与氧化铜的反应化学反应方程式现象
黑色的氧化铜粉末逐渐变溶解溶液由无色变为蓝色硫酸物理性质无色粘稠油状的液体难挥发用途硫酸是重要的化工原料生产化肥、农药、火药以及染料还可以用于冶炼金属、精炼石油和金属除锈等实验室常用它作为干燥剂特性强腐蚀性浓硫酸对皮肤、衣服等有浓硫酸对皮肤、衣服
等有如果浓硫酸不慎溅到皮肤上要先用干布拭去然后用大量水冲洗最后用小苏打溶液冲洗情况严重时(溅到皮肤上的浓硫酸较多时)应立即送往医院吸水性(物理性质)能直接吸收空气中的水分所以浓硫酸需要密封保存因此浓硫酸可以用来作为干燥剂浓硫酸是初中范围内遇到的唯⼀的⼀种液体⼲燥剂脱水性(化学性质)能把由C、H
、O等元素组成的化合物里的H、O元素按原子个数比2:1的比列从化合物中“脱出”结合成水稀硫酸的化学性质与锌粒的反应化学反应方程式现象有气泡产生与铁锈的反应化学反应方程式现象红褐色的铁锈逐渐溶解溶液由无色变为黄色与氧化铜的反应化学反应方程式现象黑色的氧化铜粉末逐渐变溶解溶液由无色
变为蓝色与氢氧化铜的反应化学反应方程式现象蓝色的氢氧化铜逐渐溶解溶液由无色变为蓝色与氯化钡的反应化学反应方程式现象产生白色沉淀滴加稀硝酸不溶解应用与硝酸联合使用用于检验硫酸和硫酸根离子的存在浓硫酸的稀释稀释浓硫酸时,必须将浓硫酸缓缓地沿器壁注入水中
同时要搅动液体以使热量及时地扩散酸的通性不同的酸在水溶液中都能电离出自由移动的氢离子所以酸具有相似的化学性质第4节常见的碱氢氧化钠三个俗名烧碱火碱苛性钠性质物理性质常态下为白色固体易潮解极易溶于水溶于水时
放出大量的热水溶液有滑腻感、有涩味化学性质具有强烈的腐蚀的性具有碱的通性(参见碱的通性)用途应用于造纸制锅制皂精炼石油等工业是重要的化工原料利用固体氢氧化钠易潮解的性质可以用与某些气体的干燥剂如氢气和氧气注意:不能用作酸性气
体的干燥剂生活中可用来除油污等氢氧化钙两个俗名熟石灰消石灰性质物理性质常态下为白色粉末状固体微溶于水溶解度随温度的升高而减小化学性质具有较强的腐蚀性具有碱的通性用途重要的建筑材料也是一种工业原料用来制取漂白粉农业上用于改良酸性土壤。。。制取将生石灰(氧化钙)溶于
水反应剧烈放出大量的热化学方程式碱的通性第5节酸和碱之间的反应酸碱中和反应概念酸和碱之间发生反应生成盐和水实质判断一个反应是不是酸碱中和反应需要满足的两个条件反应物必须是酸和碱生成物必须是盐和水生成“盐和水”的反应不一定
是中和反应酸碱反应的应用农业用途植物适宜在接近中性的土壤里生长酸性太强或碱性太强都不适宜植物的生长农业上常施加熟石灰(氢氧化钙)来降低土壤的酸性土壤的酸性主要来自酸雨矿物的风化土壤有机物的分解工业用途石
油工业精炼石油时用氢氧化钠来中和过量的酸根据工业排放的废水的酸碱性加入适宜的物质去除污水的酸碱性使之达到国家规定的排放标准用于医药卫生如胃药中含有氢氧化铝来中和过多的胃酸被蚊虫叮咬后可在患处涂含有碱性物质(
如NH₃·H₂O氨水)的药水(蚊虫能分泌出蚁酸)厨房中的应用松花蛋中含有碱性物质,人们在食用它时常加一些醋,以中和其碱性,使松花蛋美味可口在蒸馒头时,人们在经过发酵的面粉里加一些纯碱,以中和发酵产生的酸,这样蒸出的馒头松软可口第6节几种重要的盐(1)盐定义由金属阳离
子(或铵根离子)和酸根阴离子构成的化合物称为盐特征盐是酸碱反应的产物之一常见的盐晶体硝酸钾晶体(不带结晶水)化学式重铬酸钾晶体(不带结晶水)化学式硫酸亚铁晶体(带7个结晶水)化学式又称为绿矾补充矾指各种金属(如铜、铁、锌)的硫酸盐硫酸铜晶体(带5个
结晶水)化学式又称为蓝矾胆矾说明味道“苦”硫酸铝钾晶体(带12个结晶水)化学式是一种复合盐碳酸钠俗名纯碱苏打碳酸氢钠的俗名是小苏打物理性质白色粉末易溶于水化学性质水溶液呈碱性能使无色酚酞试液变红使紫色石蕊试液变蓝与酸反应生成新盐和新酸如能和某些碱反应生成新
盐和新碱如能和某些盐反应生成两种新盐如能和水反应结晶水合物在常温下,放在干燥的空气里逐渐失去结晶水的现象叫风化。风化是化学变化用途用来制造玻璃、肥皂是重要的化工原料去除油污。。。碳酸钙俗名石灰石灰石大理石石粉生活
中大理石、汉白玉、鸡蛋壳、水垢等物质主要成分都是碳酸钙物理性质白色的固体难溶于水化学性质与酸反应生成新盐和新酸如高温分解产生二氧化碳和生石灰用途用来制水泥生石灰炼钢是重要的建筑原料氯化钠俗名食盐物理性质白色固体易溶于水有咸味溶解度受温度影响不大化学性质能与某些盐反应生成两种新盐如电解食盐水
用途生活中常用来腌制蔬菜也是重要的调味品用来制取烧碱金属钠氯气等医疗上用氯化钠配置质量分数为0.9%的生理盐水浓的实验溶液可能使细胞中的水渗出从而使蛋白质凝固能用来杀菌农业上用一定浓度的氯化钠溶液来选种又称为明矾白矾钾矾钾铝矾钾明矾第6节几种重要
的盐(2)盐的分类和制取盐的分类按具有相同的离子分类阳离子相同如氯化钠碳酸钠硫酸钠硝酸钠称为钠盐阴离子相同如碳酸钠碳酸钾碳酸钙碳酸钡称为碳酸盐按盐在水中的溶解性分类可溶性盐如:碳酸钠不溶性盐如:氯化银碳酸钙硫酸钡还有些盐是微溶于水的如:硫酸钙硫酸银碳酸镁盐的制取有些盐
是天然存在的可以通过物理方法提取如从可从海水中提取食盐用化学方法制取制取盐的反应方式1、酸+金属=盐+氢气2、酸+金属氧化物=盐+水3、酸+碱=盐+水4、酸+盐=新酸+新盐5、碱+盐=新碱+新盐6、碱+酸性氧化物=盐+水7、盐+盐=新盐+新盐8、金属+盐=新金属
+新盐如侯氏制碱法复分解反应定义两种化合物互相交换成分生成两种新化合物的反应通式表示反应发生的条件盐的通性补充金属活动性顺序钾钙钠镁铝锌铁锡铅氢铜汞银铂金K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、P
t、Au快速记忆法嫁给那美女(K、Ca、Na、Mg、Al)新铁丝千斤(Zn、Fe、Sn、Pb、H)铜共一百斤(Cu、Hg、Ag、Pt、Au)第6节几种重要的盐(3)盐与化肥化肥简介农作物所必需的营养元素有碳、氢、氧、氮、磷、钾、钙、镁等其中氮、磷、钾需求量较大化学肥料简称化肥是用矿物、空气、水
等作原料,常见化肥的种类和作用氮、磷、钾三种化肥的区别方法使用农药化肥的利弊利化肥营养元素含量高肥效快而显著原料广泛可以批量生产能提高作物的产量农药是农业生产中与病、虫、杂草等有害物质作斗争的有力武器有利于农业的高产丰收弊农药化肥中含有某些重金属元素、有毒有机物以及放射性物质会造成土壤污染会产
生氮氧化物、氨气、硫化氢等气体会污染大气含有大量的营养元素容易导致水体富营养化引起赤潮、水华现象引起水体污染化肥和农药残留成分通过食物链进入人体危害人体健康经过化学加工精制而成的肥料氮肥、磷肥、钾肥是最主要的化学肥料导致